- Автор Alex Aldridge [email protected].
- Public 2023-12-17 13:49.
- Последнее изменение 2025-06-01 07:37.
Ключевая разница - сильный лиганд против слабого лиганда
Лиганд - это атом, ион или молекула, которая отдает или делит два своих электрона посредством ковалентной ковалентной связи с центральным атомом или ионом. Концепция лигандов обсуждается в рамках координационной химии. Лиганды представляют собой химические вещества, участвующие в образовании комплексов с ионами металлов. Следовательно, они также известны как комплексообразователи. Лиганды могут быть монодентатными, бидентатными, тридентатными и т.д. в зависимости от дентатности лиганда. Дентитность - это количество донорных групп, присутствующих в лиганде. Монодентатность означает, что лиганд имеет только одну донорную группу. Бидентат означает наличие двух донорных групп на одну молекулу лиганда. Есть два основных типа лигандов, классифицированных на основе теории кристаллического поля; сильные лиганды (или лиганды сильного поля) и слабые лиганды (или лиганды слабого поля). Ключевое различие между сильными лигандами и слабыми лигандами заключается в том, что расщепление орбиталей после связывания с лигандом сильного поля вызывает более высокую разницу между орбиталями более высокого и более низкого энергетического уровня, тогда как расщепление орбиталей после связывания с лигандом слабого поля вызывает более низкую разницу. между орбиталями более высокого и более низкого энергетического уровня.
Что такое теория кристаллического поля?
Теория поля кристаллов может быть описана как модель, предназначенная для объяснения нарушения вырождений (электронных оболочек равной энергии) электронных орбиталей (обычно d или f орбиталей) из-за статического электрического поля, создаваемого окружающими анион или анионы (или лиганды). Эта теория часто используется для демонстрации поведения комплексов ионов переходных металлов. Эта теория может объяснить магнитные свойства, цвета координационных комплексов, энтальпии гидратации и др.
Теория:
Взаимодействие между ионом металла и лигандами является результатом притяжения между ионом металла с положительным зарядом и отрицательным зарядом неспаренных электронов лиганда. Эта теория в основном основана на изменениях, происходящих на пяти вырожденных электронных орбиталях (у атома металла пять d-орбиталей). Когда лиганд приближается к иону металла, неспаренные электроны оказываются ближе к некоторым d-орбиталям, чем к другим d-орбиталям иона металла. Это вызывает потерю вырождения. А также электроны на d-орбиталях отталкивают электроны лиганда (потому что оба заряжены отрицательно). Следовательно, d-орбитали, расположенные ближе к лиганду, имеют более высокую энергию, чем другие d-орбитали. Это приводит к разделению d-орбиталей на d-орбитали с высокой энергией и d-орбитали с низкой энергией в зависимости от энергии.
Некоторые факторы, влияющие на это разделение: природа иона металла, степень окисления иона металла, расположение лигандов вокруг центрального иона металла и природа лигандов. После расщепления этих d-орбиталей на основе энергии разница между d-орбиталями с высокой и низкой энергией известна как параметр расщепления кристаллического поля (∆oct для октаэдрических комплексов).
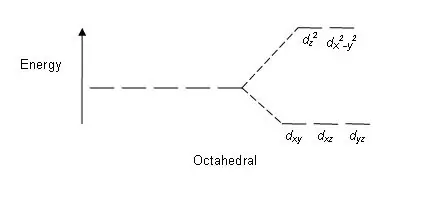
Рисунок 01: Паттерн расщепления в октаэдрических комплексах
Схема расщепления: Поскольку существует пять d-орбиталей, расщепление происходит в соотношении 2:3. В октаэдрических комплексах две орбитали находятся на высоком энергетическом уровне (вместе известные как «eg»), а три орбитали находятся на более низком энергетическом уровне (вместе известные как t2g). В тетраэдрических комплексах происходит обратное; три орбитали находятся на более высоком энергетическом уровне и две на более низком энергетическом уровне.
Что такое сильный лиганд?
Сильный лиганд или лиганд сильного поля - это лиганд, который может привести к более высокому расщеплению кристаллического поля. Это означает, что связывание лиганда сильного поля вызывает большую разницу между орбиталями более высокого и более низкого энергетического уровня. Примеры включают CN- (цианидные лиганды), NO2- (нитролиганд) и CO (карбонил лиганды).
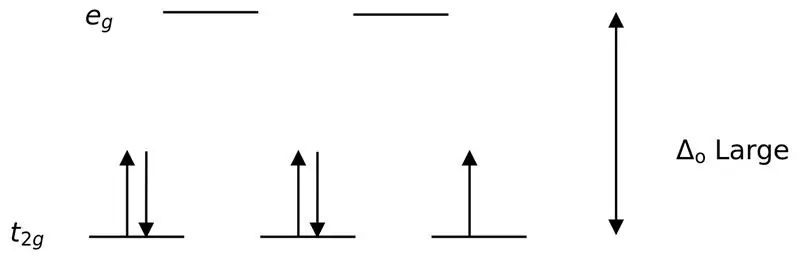
Рисунок 02: Расщепление с низким вращением
При образовании комплексов с этими лигандами сначала нижние энергетические орбитали (t2g) полностью заполняются электронами, прежде чем заполнять любые другие высокоэнергетические орбитали (например). Комплексы, образующиеся таким образом, называются «низкоспиновыми комплексами».
Что такое слабый лиганд?
Слабый лиганд или лиганд слабого поля - это лиганд, который может привести к более низкому расщеплению кристаллического поля. Это означает, что связывание лиганда слабого поля вызывает меньшую разницу между орбиталями более высокого и более низкого энергетического уровня.
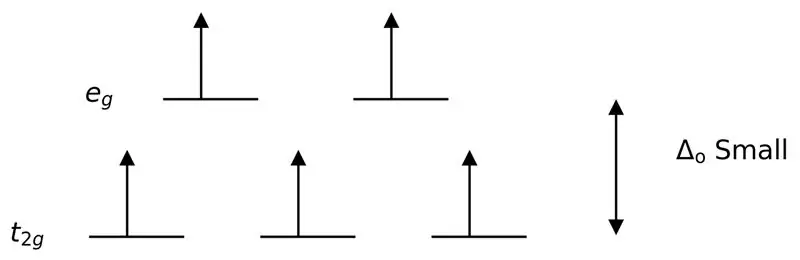
Рисунок 3: High Spin Splitting
В этом случае, поскольку небольшая разница между двумя орбитальными уровнями вызывает отталкивание между электронами на этих энергетических уровнях, орбитали с более высокой энергией могут быть легко заполнены электронами по сравнению с орбиталями с низкой энергией. Комплексы, образованные с этими лигандами, называются «высокоспиновыми комплексами». Примеры лигандов слабого поля включают I- (йодидный лиганд), Br- (бромидный лиганд) и т. д.
В чем разница между сильным лигандом и слабым лигандом?
Сильный лиганд против слабого лиганда |
|
| Сильный лиганд или лиганд сильного поля - это лиганд, который может привести к более высокому расщеплению кристаллического поля. | Слабый лиганд или лиганд слабого поля - это лиганд, который может привести к более низкому расщеплению кристаллического поля. |
| Теория | |
| Расщепление после связывания лиганда сильного поля вызывает большую разницу между орбиталями более высокого и более низкого энергетического уровня. | Расщепление орбиталей после связывания лиганда слабого поля вызывает меньшую разницу между орбиталями более высокого и более низкого энергетического уровня. |
| Категория | |
| Комплексы, образованные с лигандами сильного поля, называются «низкоспиновыми комплексами». | Комплексы, образованные с лигандами слабого поля, называются «высокоспиновыми комплексами». |
Резюме - Сильный лиганд против слабого лиганда
Сильные лиганды и слабые лиганды - это анионы или молекулы, которые вызывают расщепление d-орбиталей иона металла на два энергетических уровня. Разница между сильными лигандами и слабыми лигандами заключается в том, что расщепление после связывания лиганда сильного поля вызывает большую разницу между орбиталями более высокого и более низкого энергетического уровня, тогда как расщепление орбиталей после связывания лиганда слабого поля вызывает более низкую разницу между более высокими и более низкими орбиталями. орбитали энергетического уровня.






