- Автор Alex Aldridge [email protected].
- Public 2023-12-17 13:48.
- Последнее изменение 2025-06-01 07:37.
Ключевое различие между реакциями первого и второго порядка заключается в том, что скорость реакции первого порядка зависит от первой степени концентрации реагента в уравнении скорости, тогда как скорость реакции второго порядка зависит от второй степени концентрации член в уравнении скорости.
Порядок реакции представляет собой сумму степеней, в которые возводятся концентрации реагентов в уравнении закона скорости. В соответствии с этим определением существует несколько форм реакций; реакции нулевого порядка (эти реакции не зависят от концентрации реагентов), реакции первого порядка и реакции второго порядка.
Что такое реакции первого порядка?
Реакциями первого порядка называются химические реакции, скорость которых зависит от молярной концентрации одного из реагентов, участвующих в реакции. Поэтому, согласно приведенному выше определению порядка реакции, сумма степеней, в которые возводятся концентрации реагентов в уравнении закона скорости, всегда будет равна 1. В этих реакциях может участвовать либо один реагент. Тогда концентрация этого реагента определяет скорость реакции. Но иногда в этих реакциях участвует более одного реагента, тогда скорость реакции будет определяться одним из этих реагентов.
Давайте рассмотрим пример, чтобы понять эту концепцию. В реакции разложения N2O5 образуется NO2 и O 2 газы как продукты. Поскольку у него есть только один реагент, мы можем записать реакцию и уравнение скорости следующим образом.
2N2O5(g) → 4NO2(g) + O 2(г)
Rate=k[N2O5(g)]m
Здесь k - константа скорости этой реакции, а m - порядок реакции. Следовательно, из экспериментальных определений значение m равно 1. Таким образом, это реакция первого порядка.
Что такое реакции второго порядка?
Реакции второго порядка - это химические реакции, скорость которых зависит от молярной концентрации двух реагентов или от второй степени одного реагента, участвующего в реакции. Следовательно, согласно приведенному выше определению порядка реакции, сумма степеней, в которые возводятся концентрации реагентов в уравнении закона скорости, всегда будет равна 2. Если реагентов два, скорость реакции будет зависеть от первой степени. концентрации каждого реагента.
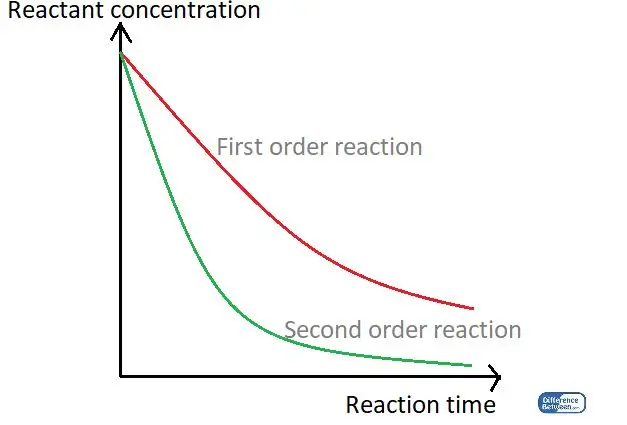
Рисунок 01: График, сравнивающий два типа реакции с указанием времени реакции и концентрации реагента.
Если увеличить концентрацию реагента в 2 раза (если в уравнении скорости два реагента), то скорость реакции увеличится в 4 раза. Например, рассмотрим следующую реакцию.
2A → P
Здесь A - реагент, а P - продукт. Тогда, если это реакция второго порядка, уравнение скорости этой реакции будет следующим.
Ставка=k[A]2
Но для реакции с двумя разными реагентами, например:
A + B → P
Rate=k[A]1[B]1
В чем разница между реакциями первого и второго порядка?
Реакциями первого порядка называются химические реакции, скорость которых зависит от молярной концентрации одного из реагентов, участвующих в реакции. Следовательно, если увеличить концентрацию реагента в 2 раза, скорость реакции увеличится в 2 раза. Реакции второго порядка - это химические реакции, скорость которых зависит от молярной концентрации двух реагентов или от второй степени одного реагента, участвующего в реакции. Следовательно, если увеличить концентрацию реагента в 2 раза, скорость реакции увеличится в 4 раза. Приведенная ниже инфографика представляет разницу между реакциями первого и второго порядка в табличной форме.

Резюме - реакции первого и второго порядка
Есть три основных типа реакций в зависимости от порядка реакции; реакции нулевого, первого и второго порядка. Ключевое различие между реакциями первого и второго порядка заключается в том, что скорость реакции первого порядка зависит от первой степени концентрации реагента в уравнении скорости, тогда как скорость реакции второго порядка зависит от второй степени члена концентрации в уравнении скорости. уравнение скорости.






