- Автор Alex Aldridge [email protected].
- Public 2023-12-17 13:49.
- Последнее изменение 2025-06-01 07:37.
Ключевое различие между альфа- и бета-спиралями зависит от типа водородной связи, которую они образуют при развитии этих структур. Альфа-спирали образуют внутримолекулярные водородные связи, а бета-спирали образуют межмолекулярные водородные связи.
Сложные белки имеют четыре уровня структурной организации - первичный, вторичный, третичный и четвертичный. Вторичные структуры белков образуют пептидные цепи различной ориентации. Пептидные цепи состоят из аминокислотных последовательностей, связанных пептидными связями. Следовательно, в белках есть две основные вторичные структуры: альфа-спираль и бета-спираль. Кроме того, существуют другие вторичные структуры, называемые структурами бета-поворота и шпильки. В основном эта статья посвящена разнице между альфа- и бета-спиралями.
Что такое Alpha Helix?
Белки имеют четыре структурных уровня организации. Из них альфа-спираль является наиболее распространенной вторичной структурой белков. И эта структура выглядит как стержень, намотанный вокруг центральной оси. Кроме того, альфа-спираль является правосторонней спиралью. Однако могут присутствовать и левые спирали. Здесь пептидные связи образуются от амино-конца к карбокси-концу. Аминокислоты соединяются друг с другом посредством этих пептидных связей. Внутримолекулярные водородные связи являются основной причиной образования альфа-спирали.
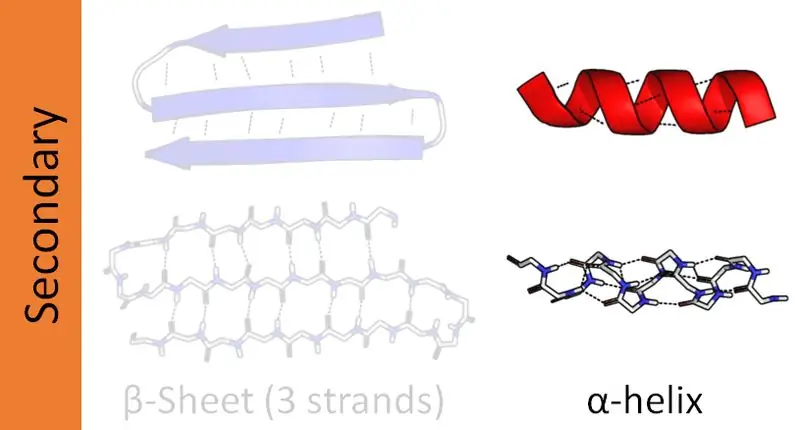
Рисунок 01: Альфа-спираль
Расположение альфа-спирали зависит от гидрофильной и гидрофобной природы белка. Если аминокислотная последовательность состоит из большого количества гидрофильных групп R (вариабельных), группы R ориентируются на водную фазу. Если вариабельные группы гидрофобны, они будут выступать за гидрофобную фазу окружающей среды. В любом случае группы R выходят за пределы спиральной структуры. Благодаря этим структурным характеристикам альфа-спираль более устойчива к мутациям. Таким образом, наличие водородных связей стабилизирует структуру альфа-спирали. На один виток альфа-спирали приходится в среднем 3,6 остатка, так как для образования водородных связей требуется 3,6 остатка. Некоторые структурные белки, такие как коллаген и кератин, богаты альфа-спиралями.
Что такое Beta Helix?
Бета-спираль является второй наиболее распространенной вторичной структурой белка. Хотя это не так распространено, как альфа-спираль, присутствие бета-спирали также играет важную роль в структуре белка. Формирование бета-спирали происходит за счет двух бета-листов, расположенных либо параллельно, либо антипараллельно. Затем эти листы образуют спиральную структуру. Межмолекулярные водородные связи между двумя нитями листа способствуют образованию бета-спирали.

Рисунок 02: Бета-спираль
Бета-спирали могут быть как правосторонними, так и левосторонними, в зависимости от их схемы связывания. При формировании бета-спирали вариабельные группы двух бета-листов располагаются внутри ядра спирали. Следовательно, большинство групп, образующих бета-листы, обладают гидрофобными функциями.
В отличие от альфа-спирали, 17 остатков образуют один виток в бета-спирали. Ионы металлов обладают способностью активировать образование бета-спирали. Подобно альфа-спирали, водородные связи поддерживают структуру бета-спирали. Фермент карбоангидраза и пектатлиаза представляют собой два белка, богатых бета-спиралями.
Каковы сходства между альфа- и бета-спиралями?
- Альфа и Бета Спираль - это две вторичные структуры белков.
- Аминокислоты являются мономерами обеих вторичных структур.
- Кроме того, химическими составляющими альфа- и бета-спиралей являются углерод, водород, кислород, азот и сера.
- Кроме того, обе вторичные структуры развиваются в организацию более высокого уровня.
- Кроме того, оба стабилизированы водородными связями.
- В обеих структурах гидрофобность определяется наличием групп R аминокислот.
В чем разница между Alpha и Beta Helix?
Ключевое различие между альфа- и бета-спиралями заключается в типе водородных связей, которые они демонстрируют. Альфа-спираль показывает внутримолекулярную водородную связь, а бета-спираль показывает межмолекулярную водородную связь. Кроме того, альфа-спираль образует правостороннюю спираль, тогда как бета-спираль может формировать как правостороннюю, так и левостороннюю спираль. Итак, это также существенная разница между альфа- и бета-спиралями.
Более того, еще одно различие между альфа- и бета-спиралями заключается в том, что образование альфа-спирали происходит за счет скручивания аминокислотной последовательности, тогда как при образовании бета-спирали два бета-листа, параллельные или антипараллельные, связаны друг с другом. образуют спиральную структуру.
Приведенная ниже инфо-графика представляет дополнительную информацию о разнице между альфа- и бета-спиралями.

Резюме - Альфа и Бета Helix
И альфа-спирали, и бета-спирали важны для идентификации и дедукции сложных белковых структур. Оба типа являются вторичными структурами белков. Однако альфа-спираль представляет собой спиральный поворот аминокислотных последовательностей. Напротив, образование бета-спирали происходит посредством водородной связи параллельных или антипараллельных бета-листов. Кроме того, водородная связь является внутримолекулярной в форме альфа-спирали, тогда как водородная связь является межмолекулярной в форме бета-спирали. Кроме того, обе эти структуры имеют группу R, которая определяет гидрофобность белка. Таким образом, это суммирует разницу между альфа- и бета-спиралями.






